جوهرة فلسطين
Admin

عدد المساهمات : 111
نقاط : 280
السٌّمعَة : 1
تاريخ التسجيل : 10/09/2009
 |  موضوع: تراكيب لويس موضوع: تراكيب لويس  السبت مارس 13, 2010 10:17 pm السبت مارس 13, 2010 10:17 pm | |
| تراكيب لويس [/COLOR] يمكن تمثيل جزيئات المركبات التساهمية وتوضيح كيفية تكون الروابط فيها عن طريق ما يعرف باسم تركيب لويس ، وفيما يلي سنتعرف على تركيب لويس لبعض الذرات وبعض الجزيئات التساهمية :
img] 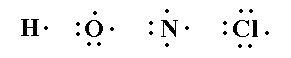 [/img [img]  r=blue]يلاحظ من خلال هذه التراكيب أن هناك أزواج الكترونية رابطة ( روابط تساهمية ) وأزواج الكترونية غير رابطة ( أزواج الكترونية حرة ) . r=blue]يلاحظ من خلال هذه التراكيب أن هناك أزواج الكترونية رابطة ( روابط تساهمية ) وأزواج الكترونية غير رابطة ( أزواج الكترونية حرة ) .
تطبيق : وضح تركيب لويس لكلٍ من الجزيئات التساهمية التالية :
جزيء الهيدروجين ، جزيء النيتروجين ، جزيء الماء : النشادر , الميثان ، فلوريد الهيدروجين ، كلوريد الهيدروجين ، فلوريد البورون ، ، كلوريد البريليوم ، خامس كلوريد الفسفور .
القاعدة الثمانية
يلاحظ في تراكيب لويس أن الذرات ( المركزية والطرفية ) في الجزيء التساهمي تحاط بثمانية الكترونات ( بالنسبة للهيدروجين الكترونين ) لتصل بذلك إلى التركيب الالكتروني الثابت والمستقر لتماثل التركيب الالكتروني لأقرب غاز خامل ، تعرف هذه الظاهرة باسم القاعدة الثمانية ، وبالرغم من أن هذه الظاهرة تنطبق على معظم الجزيئات التساهمية إلا أن هناك شذوذاً عن هذه القاعدة إما بأكثر من ثمانية الكترونات كما هو الحال في خامس كلوريد الفسفور ( يوجد عشرة الكترونات حول ذرة الفسفور المركزية ) أو أقل من ثمانية كما هو الحال في فلوريد البورون ( ستة الكترونات حول ذرة البورون المركزية ) .[img]  [/img] جزيء ثالث فلوريد الفسفور يتبع القاعدة الثمانية
[img]  [/img] جزيء خامس فلوريد الفسفور يشذ عن القاعدة الثمانية
] | |
|
جوهرة فلسطين
Admin

عدد المساهمات : 111
نقاط : 280
السٌّمعَة : 1
تاريخ التسجيل : 10/09/2009
 |  موضوع: رد موضوع: رد  الإثنين أبريل 05, 2010 12:15 am الإثنين أبريل 05, 2010 12:15 am | |
| [img]  [/img] | |
|


